Zmiękczanie wody w procesie wymiany jonowej oraz problem regeneracji złóż jonitowych
Usuwanie związków powodujących twardość wody nazywane jest zmiękczaniem wody. Proces ten ma zastosowanie głownie w branży przemysłowej, np. chłodniczej, kotłowej czy technologicznej. Jedną z metod zmiękczania wody jest zmiękczanie na jonitach.
Cały układ jonitowego zmiękczania wody oraz rodzaj stosowanych kationitów musi być ustalany indywidualnie dla każdego rodzaju wody. W związku z tym, stosuje się wymianę jonową:
1) w cyklu wodorowym na kationach słabo kwaśnych celem usunięcia twardości węglanowej. Proces ten zachodzi zgodnie z reakcjami:
2 KtsH + Ca(HCO3)2 ↔ (2 Kts)Ca + 2 H2O + 2 CO2
2 KtsH + Mg(HCO3)2 ↔ (2 Kts)Mg + 2 H2O + 2 CO2
KtsH + NaHCO3 ↔ KtsNa + H2O + CO2
Kationity te, po regeneracji sporym nadmiarem reagenta (najczęściej jest to HCl), mogą wymieniać także kationy związane z resztami kwasowymi silnych kwasów według reakcji:
2 KtmH + CaCl2 → 2 (Ktm)Ca + 2 HCl
Przedstawiony sposób wymiany jonowej stosuje się do zmiękczania wody mającej dużą twardość węglanową i zawierającej NaHCO3. Uzyskana woda zawiera CO2 i jest pozbawiona twardości węglanowej. Poza tym usuwana jest, zgodnie z powyższą reakcją, część twardości niewęglanowej, a w wodzie obecne są kwasy mineralne. Aby usunąć CO2 z wody stosuje się odgazowywacze.
Pierwszy z kationitów zapewnia dekarbonizację wody i jej częściowe odsolenie według poniższych reakcji:
2 KtsH + Ca(HCO3)2 ↔ (2 Kts)Ca + + 2 H2O + 2 CO2
2 KtsH + Mg(HCO3)2 ↔ (2 Kts)Mg + 2 H2O + 2 CO2
KtsH + NaHCO3 ↔ KtsNa + H2O + CO2
natomiast drugi z kationitów (KtmNa) powoduje wymianę kationów powodujących twardość niewęglanową:
2 KtmNa + CaCl2 ↔ (2 Ktm)Ca + 2 NaCl
2 KtmNa + MgSO4 ↔ (2 Ktm)Mg + Na2SO4
Pomiędzy jonitami powinien znajdować się odgazowywacz, aby odpędzić dwutlenek węgla obecny w wodzie po dekarbonizacji.
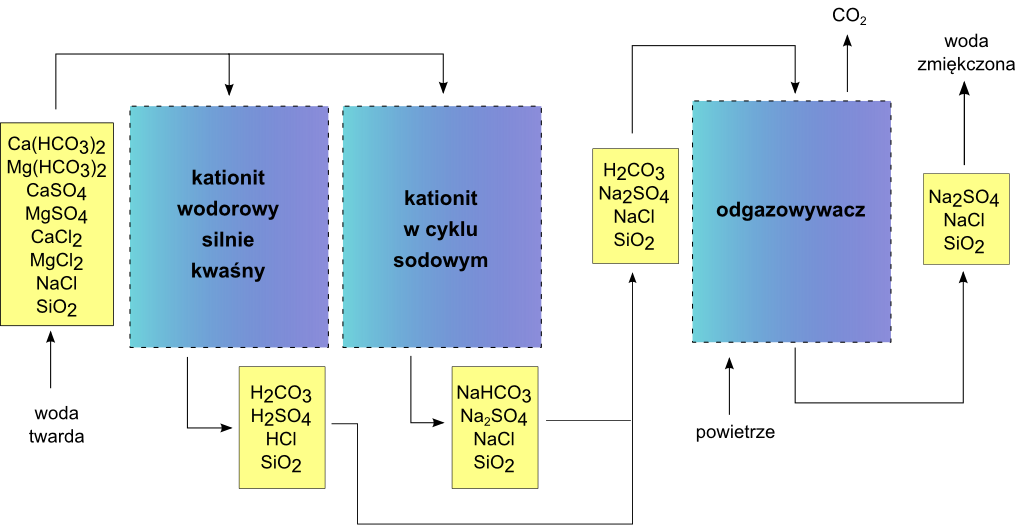
Czasami zamiast układu dwukolumnowego stosuje się kolumnę zawierającą złoże dwuwarstwowe. W takim złożu górną warstwę stanowi KtsH regenerowany HCl, a dolną warstwę KtmNa regenerowany NaCl. Rozwiązanie to pozwala na jednoczesną dekarbonizację i dekationizację wody i jest zalecane do wód o twardości węglanowej stanowiącej ok. 30 – 80% twardości ogólnej.
* układ II stanowią szeregowo połączone kationity (silnie kwaśny pracujący w cyklu wodorowym i silnie kwaśny pracujący w cyklu sodowym)
Zastosowanie takiego rozwiązania jest celowe, gdy woda kierowana na jonity ma zasadowość alkaliczną oraz małą ilość jonów chlorkowych i siarczanowych (tj. < 0,5 val/m3). Otrzymana w takim układzie woda ma charakter korozyjny, wymaga usunięcia CO2 i neutralizacji kwasów mineralnych.
* układ III stanowią równolegle połączone dwa silnie kwaśne kationity pracujące w cyklu wodorowym i sodowym
W układzie takim kationit wodorowy wymienia wszystkie kationy na jon wodorowy:
2 KtmH + Ca(HCO3)2 ↔ (2 Ktm)Ca + + 2 H2O + 2 CO2
2 KtmH + Mg(HCO3)2 ↔ (2 Ktm)Mg + 2 H2O + 2 CO2
2 KtmH + CaCl2 ↔ (2 Ktm)Ca + 2 HCl
2 KtmH + MgSO4 ↔ (2 Ktm)Mg + H2SO4
a wymiana jonów na KtmNa przebiega w następujący sposób:
2 KtmNa + Ca(HCO3)2 ↔ (2 Ktm)Ca + 2 NaHCO3
2 KtmNa + Mg(HCO3)2 ↔ (2 Ktm)Mg + 2 NaHCO3
2 KtmNa + CaCl2 ↔ (2 Ktm)Ca + 2 NaCl
2 KtmNa + MgSO4 ↔ (2 Ktm)Mg + Na2SO4
Woda po obu kolumnach jest mieszana ze sobą w odpowiednich proporcjach, w wyniku czego następuje neutralizacja kwasów mineralnych, obecnych po wymianie w cyklu wodorowym, przez wodorowęglan sodu obecny w wycieku z KtmNa, zgodnie z reakcjami:
NaHCO3 + HCl ↔ NaCl + H2O + CO2
2 NaHCO3 + H2SO4 ↔ Na2SO4 + 2 H2O + 2 CO2
Ostatecznym wynikiem zastosowania takiego rozwiązania jest dekarbonizacja wody, jej zmiękczenie oraz znaczne odsolenie. Aby usunąć CO2 ze zmiękczonej wody należy zastosować jego desorpcję.
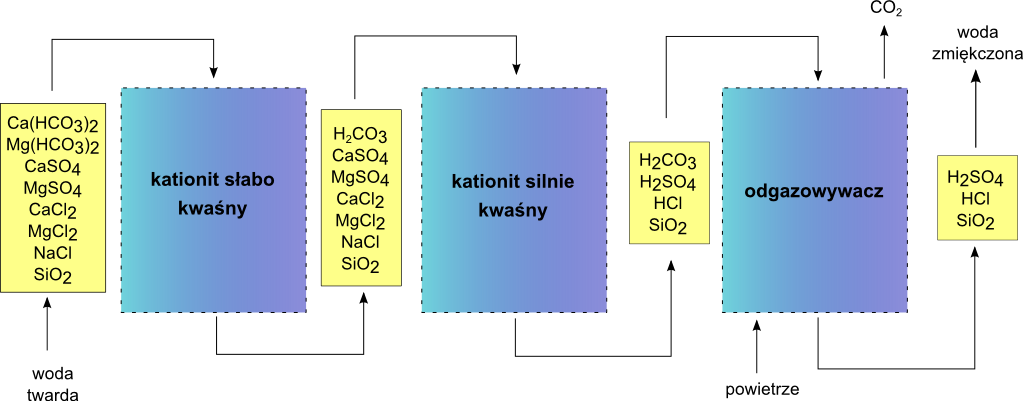
4) w cyklu wodorowym (słabo kwaśny kationit – silnie kwaśny kationit)
Zastosowanie wymiany jonowej na kationitach pracujących w cyklu wodorowym zapewnia usunięcie twardości węglanowej i niewęglanowej. Jonitowa dekarbonizacja:
2 KtsH + Ca(HCO3)2 ↔ (2 Kts)Ca + 2 H2O + 2 CO2
2 KtsH + Mg(HCO3)2 ↔ (2 Kts)Mg + 2 H2O + 2 CO2
KtsH + NaHCO3 ↔ KtsNa + H2O + CO2
przebiega na słabo kwaśnym kationicie. Natomiast wymiana kationów związanych z resztami silnych kwasów:
2 KtmH + CaCl2 ↔ (2 Ktm)Ca + 2 HCl
2 KtmH + MgSO4 ↔ (2 Ktm)Mg + H2SO4
zachodzi na kationicie silnie kwaśnym.
W takim układzie kationit słabo kwaśny zmniejsza obciążenie jonowe kationitu silnie kwaśnego. Czynnik regenerujący, przepływając w kierunku od dołu ku górze (najczęściej jest to roztwór HCl), regeneruje najpierw kationit silnie kwaśny, a następnie dopiero kationit słabo kwaśny. Efekt jednoczesnej dekarbonizacji i dekationizacji można również uzyskać stosując jedną kolumnę jonowymienną wypełnioną złożem dwuwarstwowym. W takim złożu kationit słabo kwaśny, będący górną warstwą, stanowi do 50% objętości złoża, a regenerację złoża należy prowadzić przeciwprądowo. Otrzymana woda po kationicie pracującym w cyklu wodorowym ma charakter korozyjny, wymaga usunięcia CO2 i neutralizacji kwasów mineralnych.
5) dekarbonizacja i dekationizacja na kationicie silnie kwaśnym pracującym w cyklu sodowym i anionicie silnie zasadowym pracującym w cyklu chlorkowym
Taki układ może być realizowany z użyciem oddzielnych szeregowo połączonych kolumn (silnie kwaśny kationit pracujący w cyklu sodowym i silnie zasadowy anionit pracujący w cyklu chlorkowym) lub w jednej kolumnie (zawierającej AnmCl i KtmNa). Wykorzystanie kationitu i anionitu zapewnia jednoczesną dekationizację i dekarbonizację bez konieczności usuwania CO2 (jako NaHCO3 jest on wymieniany na anionicie). Opisany proces przedstawiają reakcje:
NaHCO3 + AnmCl ↔ AnmHCO3 + NaCl
Na2SO4 + 2 AnmCl ↔ (2 Anm)SO4 + 2 NaCl
Anionit silnie zasadowy w formie chlorkowej pozwala na wymianę także innych anionów na jony chlorkowe, a uzyskana woda jest rozcieńczonym roztworem NaCl. Rozwiązanie takie jest rzadko stosowane w technologii oczyszczania wody ze względu na duży koszt silnie zasadowego anionitu, znaczny wzrost stężenia chlorków oraz duże zużycie NaCl do regeneracji złoża.
Anionit silnie zasadowy w formie chlorkowej pozwala na wymianę także innych anionów na jony chlorkowe, a uzyskana woda jest rozcieńczonym roztworem NaCl. Rozwiązanie takie jest rzadko stosowane w technologii oczyszczania wody ze względu na duży koszt silnie zasadowego anionitu, znaczny wzrost stężenia chlorków oraz duże zużycie NaCl do regeneracji złoża.
O przebiegu i efektach wymiany jonów w następnym cyklu decyduje regeneracja właściwa jonitów. Jej celem jest przywrócenie zużytemu złożu jonowymiennemu pierwotnej zdolności wymiennej. Polega ona na usunięciu z grup funkcyjnych przyłączonych w czasie wymiany przeciwjonów i wprowadzeniu na ich miejsce odpowiednich jonów ruchliwych. Można to uzyskać przepuszczając przez regenerowane złoże roztwór czynnika regenerującego w ilości większej niż zapotrzebowanie teoretyczne. Zwykle jest to 2 – 5% roztwór czynnika regenerującego i jego nadmiar do 30%. Najczęściej do regeneracji złóż jonitowych stosuje się roztwory HCl, NaCl, CaCl2, NaOH, NH4OH, Na2CO3 lub H2SO4 (rzadko). Czas regeneracji wynosi od 20 do 30 minut (dla kationitów jest krótszy niż dla anionitów), a prędkość przepływu czynnika regenerującego przez złoże wynosi od 2 do 5 m/h. Dość kłopotliwe jest przeprowadzenie właściwej regeneracji wymienników dwujonitowych (tzw. mieszanych) zawierających kationit i anionit. Wynika to przede wszystkim z trudności określenia ilości czynników regenerujących anionit i kationit. W rozwiązaniach, w których stosuje się kationit pracujący w cyklu wodorowym i anionit w cyklu wodorotlenowym z roztworem NaOH, wprowadza się jony Na+ wykorzystujące zdolność wymienną kationitu, a aniony (obecne w roztworach użytych do regeneracji kationitu) zużywają zdolność wymienną anionitu. W praktyce dąży się do stosowania takich sposobów regeneracji, które pozwoliłyby zmniejszyć zużycie reagentów oraz ilość ścieków powstających w wyniku regeneracji. Jednym z takich rozwiązań jest regeneracja przeciwprądowa (trudna do stosowania w warunkach technicznych), podgrzewanie roztworów reagentów, stosowanie w układzie szeregowo połączonych kationitów słabo i silnie kwaśnych oraz anionitów słabo i silnie zasadowych lub też powtórne wykorzystywanie do wstępnej regeneracji ostatniej objętości niecałkowicie wykorzystanego czynnika regenerującego.
Najczęściej do regeneracji, podczas której reakcje przebiegają w odwrotną stronę, w praktyce stosuje się chlorek sodu, gdyż wytworzone wówczas chlorki wapnia i magnezu dobrze rozpuszczają się w wodzie. Niestety niesie to za sobą problem nadmiernego zasolenia wód i ścieków. Zasoleniem nazywamy groźne zanieczyszczenie wody/ścieków, które polega na nadmiernej koncentracji łatwo rozpuszczalnych soli chlorków i siarczanów. Dostarczane są one m. in. na skutek zrzutu słonych wód kopalnianych (55%), ścieków przemysłowych (23%) lub też wskutek stosowania zmiękczaczy regenerowanych solą oraz niewłaściwego nawożenia mineralnego gleb (22%).
Wody zasolone definiuje się jako takie, w których stężenie sumy jonów chlorkowych i siarczanowych przekracza 1 800 g/m3. Można je podzielić na:
* wody miernie zasolone, w których stężenie jonów chlorkowych i siarczanowych zawiera się w przedziale 1 800 – 42 000 g/m3,
* wody silnie zasolone, w których stężenie jonów chlorkowych i siarczanowych przekracza 42 000 g/m3.
Najpowszechniej występującymi ściekami zasolonymi w przemyśle są ścieki z regeneracji jonitów przy zmiękczaniu i demineralizacji wody. Głównym źródłem tych ścieków są kotłownie, elektrownie i elektrociepłownie. Ponadto znaczny ładunek soli wprowadzany jest przez wody (ścieki) potrawienne, głównie z hut. Na podstawie orientacyjnych szacunków, uwzględniających z jednej strony ilość ścieków przemysłowych (bez wód pochłodniczych) oraz ich zasolenie, a z drugiej strony zużycie przez przemysł NaCl, HCl i H2SO4, można przyjąć, że zakłady przemysłowe wprowadzają do wód ładunek soli wahający się w granicach 400 000 – 800 000 ton rocznie. Coraz częściej wskazuje się, że wzrost zasolenia ścieków może być wynikiem problemów związanych właśnie z zagospodarowaniem koncentratów powstających podczas demineralizacji i odsalania wody.
Wody zasolone nie mogą być wykorzystywane ani w rolnictwie ani w przemyśle, a ich oczyszczanie jest bardzo trudne i wymaga znacznego nakładu kosztów. Poza tym, nadmierne stężenie soli w rzekach, po zrzucie ścieków zasolonych, niszczy ich faunę i florę, powoduje korozję instalacji przemysłowych, zakładów korzystających z takiej wody, a także korozję sieci wodociągowych i kanalizacyjnych.
Podwyższone zasolenie wody może wpływać na populację mikroorganizmów realizujących proces biologicznego oczyszczania ścieków. Niewiele zwierząt lub roślin na kuli ziemskiej toleruje jednocześnie warunki środowiska zasolonego lub niezasolonego. Oddziaływanie chlorków zasadniczo wiąże się ze zmianami ciśnienia osmotycznego. Zakłóca ono czynności fizjologiczne mikroorganizmów, w tym mechanizmy transportu przez błony komórkowe, przy czym chlorki w zasadzie nie podlegają reakcją biochemicznym. Poza tym, znaczne zasolenie wody skutkuje pogorszeniem efektywności usuwania związków organicznych ze ścieków. Doniesienia literaturowe dotyczące procesów nitryfikacji i denitryfikacji w ściekach silnie zasolonych nie są całkowicie jednoznaczne. Większość badań wskazuje na dużą zdolność aklimatyzacji tych procesów przy zasoleniu chlorkami rzędu 10 kg Cl‑/m3. Taki zakres tolerancji wynika z większej wrażliwości bakterii nitryfikacyjnych, podczas gdy organizmy denitryfikujące wykazują wyższą odporność na podwyższone zasolenie ścieków.
Zupełnie inaczej wygląda problem zasolenia ścieków przy coraz częściej i powszechnie wdrażanej technice wzmożonego biologicznego usuwania fosforu. Wykazano możliwość bardzo silnej inhibicji procesu wzmożonego biologicznego usuwania fosforu już przy stosunkowo niewielkim zasoleniu ścieków. Odnotowano wzmożone usuwanie fosforanów jedynie przy względnie niskiej zawartości chlorku sodu, tj. 0,03% – 0,1%. Przy wzroście stężenia NaCl od 0% - 6% obserwuje się znaczne pogorszenie efektywności procesu (z 84% do 22%).
Oprócz tego, udowodniono, że stężenie jonów sodu powyżej 3500 g/m3 znacznie ogranicza procesy anaerobowe, a stężenie jonów chlorkowych powyżej 180 g/m3 hamuje proces nitryfikacji. Typowe stężenie jonów sodu i jonów chlorkowych w solance poregeneracyjnej wynosi odpowiednio 6 000 g/m3 i 10 000 g/m3.
Procesy wstępnego oczyszczania ścieków zachodzące w szambie mogą być zakłócone przez obecność dużej ilości soli (2 kg/tydzień). Obserwuje się wówczas wyraźną tendencję do rozwarstwiania się ścieków i rozrastania na powierzchni słonego kożucha, co jest bardzo niekorzystne z punktu widzenia eksploatacji tych urządzeń. Niektórzy producenci systemów oczyszczania ścieków wręcz zawierają w gwarancji klauzulę zakazującą oczyszczania ścieków zawierających solanki poregeneracyjne.
Obecność słonych ścieków powoduje spadek wydajności oczyszczalni ścieków. Aktualnie szacuje się, że obecność solanki w ściekach może nawet potroić koszty inwestycyjne i eksploatacyjne systemu oczyszczania ścieków – pogorszeniu ulega wydajność procesów oczyszczania jak i szybciej zużywają się instalacje.
Nadmierne zasolenie wód przedostających się do środowiska naturalnego powoduje pogorszenie jakości wód podziemnych, co z kolei wpływa negatywnie m. in. na plony.
Celem stosowania zmiękczaczy regenerowanych solą jest wyprodukowanie wody miękkiej, czyli takiej, która charakteryzuje się niskim stężeniem minerałów i lekko kwaśnym odczynem. Niestety zbyt miękka woda ma negatywny wpływ na organizm ludzki – w przeciwieństwie do wody twardej, która na ogół ma obojętny lub pozytywny wpływ. Dlatego też nie jest wskazane zmiękczanie twardej wody spożywczej. Badania wskazują, że śmiertelność z powodu chorób naczyniowych jest większa u osób pijących wodę miękką. Również występuje zależność pomiędzy ciśnieniem tętniczym a twardością wody przeznaczonej do spożycia przez ludzi. Picie wody zmiękczonej na jonicie regenerowanym solą przez ludzi na diecie niskosodowej może być bardzo szkodliwe ze względu na obecność jonów sodu, które podczas zmiękczania zastąpiły jony wapnia i magnezu. Poza tym, wody miękkie sprzyjają rozwojowi procesu korozji w przewodach wodociągowych oraz łatwiej wypłukują metale ciężkie (miedź, ołów) z instalacji sanitarnych, zwłaszcza po podgrzaniu wody. Uznaje się, że wyprodukowanie 1000 litrów wody miękkiej omawianą metodą powoduje powstanie ok. 100 litrów zasolonych ścieków.
Ze względu na powstawanie zasolonych ścieków, wysokich kosztów ich oczyszczania, ich oddziaływania na zasoby wody słodkiej i ilość plonów, jak również na zdrowie konsumentów, w Stanach Zjednoczonych coraz częściej zabrania się stosowania zmiękczaczy regenerowanych solą. Na razie zakazy te są wprowadzane lokalnie i leżą w gestii lokalnych władz i samorządów. Zakazy takie wprowadzono w stanach Kalifornia, Michigan, Connecticut, Texas, Massachusetts i dotyczą zarówno używania jak i instalowania nowych zmiękczaczy regenerowanych solą. Kalifornia jest pionierem w stosowaniu tego zakazu, a wynika to z dużej gęstości zaludnienia na obszarach dotkniętych niedoborem wody słodkiej. W Santa Clara już w 1961 roku wprowadzono całkowity zakaz stosowania automatycznych zmiękczaczy regenerowanych solą w przemyśle, a od 2003 roku również zakaz ich instalowania w nowych domach. Od 2005 roku lokalne społeczności tego stanu mają prawo na swoim terenie zabronić używania tego typu zmiękczaczy. Do sierpnia 2014 roku 25 społeczności tego stanu wdrożyło ten zakaz. Czasami wynika to z wysokości kar nakładanych za przekroczenie norm jakości oczyszczonych ścieków, a czasami wynika z protestów farmerów, których uprawy są niszczone przez zasolenie wód gruntowych.
Obecnie w Europie nie wprowadzono zakazu stosowania soli do regeneracji zmiękczaczy, ale widząc z jaką szybkością wprowadza się go w USA, można przypuszczać, że mając na uwadze szeroko pojętą ochronę środowiska, kwestią czasu będzie rezygnacja z tej metody zmiękczania na rzecz metod alternatywnych.